知识梳理
考点1 常见盐的特性及用途
1.盐的概念:是指由金属离子(或铵根离 子)和酸根离子组成的化合物。
2.几种常见盐的性质和用途
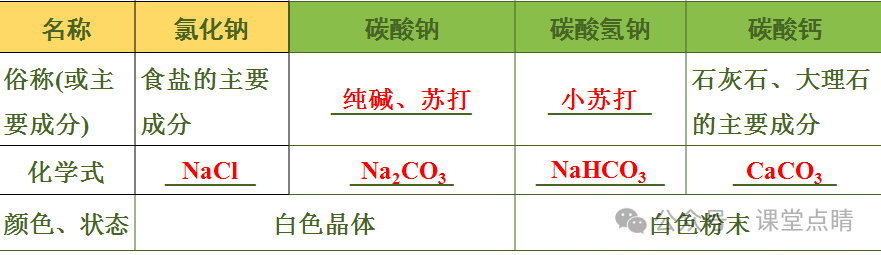
名称 | 氯化钠 | 碳酸钠 | 碳酸氢钠 | 碳酸钙 |
水溶性 | 易溶于水 | 易溶于水 | 能溶于水 | 难溶于水 |
水溶液酸碱性 | 中性 | 碱性 | 碱性 | |
主要用途 | 作调味剂,配制医用生理盐水,制盐酸、氯气等化工 原料 | 广泛应用于玻璃、造纸、纺织、洗涤剂生产等领域 | 治疗胃酸过多症,作发酵剂、灭火剂原料 | 建筑材料,制 熟石灰的原料,补钙剂 |
【备考补充】联合制碱法(侯氏制碱法)
①发明者:侯德榜;
②制作过程:向饱和食盐水中先后通入氨气和二氧化碳,生成小苏打和氯化铵;
③化学方程式:NH3+H2O+CO2+NaCl =NH4Cl+NaHCO3↓;
④意义:该方法将制碱与制氨结合起来,大大提高了原料的利用率。
考点2 盐的化学性质
1.盐和金属反应(置换反应)
通式:盐十金属-->新盐+新金属
条件:①参加反应的金属的活动性必须比盐中金属的活动性强(K、Ca、Na除外);
②参加反应的盐必须可溶。
举例: (1)铁片与硫酸铜溶液
化学方程式: Fe+CuSO4=FeSO4+Cu
现象:铁片表面有红色固体生成,溶液蓝色变浅
(2)铜片与硝酸银溶液
化学方程式: Cu+ 2AgNO3=CuNO3) 2+2Ag
现象:铜片表面有固体生成,溶液由无色变为蓝色
2.盐和酸反应(复分解反应)
通式:盐+酸- >新酸+新盐
条件:生成物中有沉淀、气体或水。
举例:碳酸钙与稀盐酸
化学方程式: CaCO3+ 2HCl=CaCl2 +H2O+CO2↑
现象:有气泡产生(实验室制取二氧化碳)
3.盐和碱反应(复分解反应)
通式:盐+碱→新碱十新盐
条件:①参加反应的盐与碱必须可溶;
②生成物中至少有一种沉淀(碱与铵盐反应除外)。
举例: (1)碳酸钠溶液与氢氧化钙溶液
化学方程式: Na2CO3 +Ca(OH)2=CaCO3↓ 十2NaOH
现象:有白色沉淀产生
(2)硫酸铜溶液与氢氧化钠溶液
化学方程式:_CuSO4+ 2NaOH= Cu(OH)2↓+ Na2SO4
现象:有蓝色沉淀产生
4.盐和盐反应(复分解反应)
通式:盐+盐- >新盐+新盐
条件:①参加反应的两种盐必须可溶;
②生成物中至少有一种沉淀。
举例:碳酸钠溶液与氯化钙溶液
化学方程式: Na2CO3+ CaCl2=CaCO3↓+ 2NaCl
现象:有色沉淀产生



